Amiloidosis de cadenas ligeras - Explicacion Articulo
¿Qué estamos estudiando?
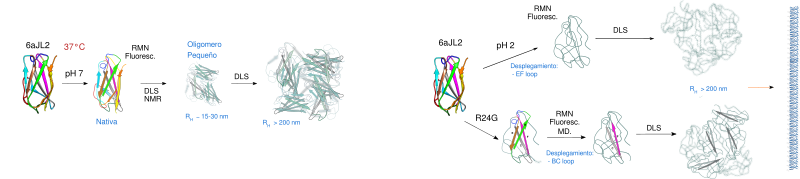
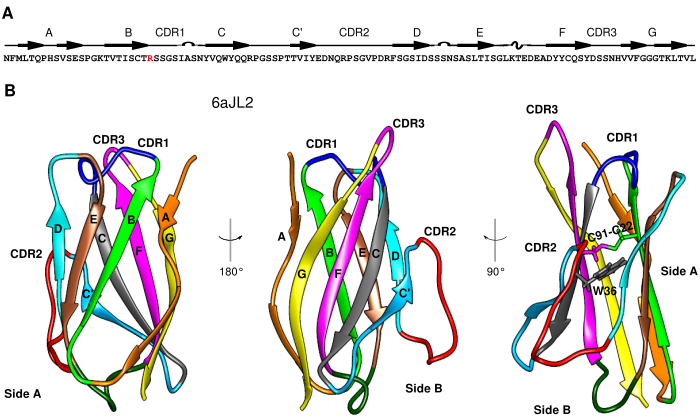
La amiloidosis de cadenas ligeras (AL) es una enfermedad mortal debida a la acumulación de agregados de proteína en distintos órganos, principalmente el corazón, los riñones y el hígado. Las cadenas ligeras se agrupan en dos clases, kappa (κ) y lambda (λ). En especifico, la proteína 6aJL2 se ha relacionado con ~22% de la AL de tipo λ; además, se ha observado que el 25% de estas proteínas amiloidogénicas presentan una mutación de Arg a Gly en la posición 24. El mecanismo molecular detrás de los cambios conformacionales que resultan en la formación de fibras amiloides no es claro. Lo más probable es que se trate de un evento multifactorial, donde elementos como mutaciones somáticas desestabilizadoras, proteólisis inespecífica y variación en el ambiente local, entre otros, pueden potenciar los cambios estructurales asociados al proceso de fibrilación.
¿Cómo lo estudiamos?
Para conocer mejor los mecanismos moleculares que conducen a la formación de fibras amiloides en la línea germinal 6a en función del tiempo, evaluamos el proceso de agregación utilizando técnicas dependientes del tiempo. Estudiamos el sistema fuera de equilibrio, perturbando el estado nativo con una mutación (R24G), pH y temperatura (37 °C). Los cambios con respecto al estado nativo se investigaron utilizando una combinación de métodos biofísicos, como son dispersión dinámica de la luz (DLS), microscopía electrónica, espectroscopia de fluorescencia, resonancia magnética nuclear (RMN) y simulaciones por computadora (MD).
¿Qué aprendimos?
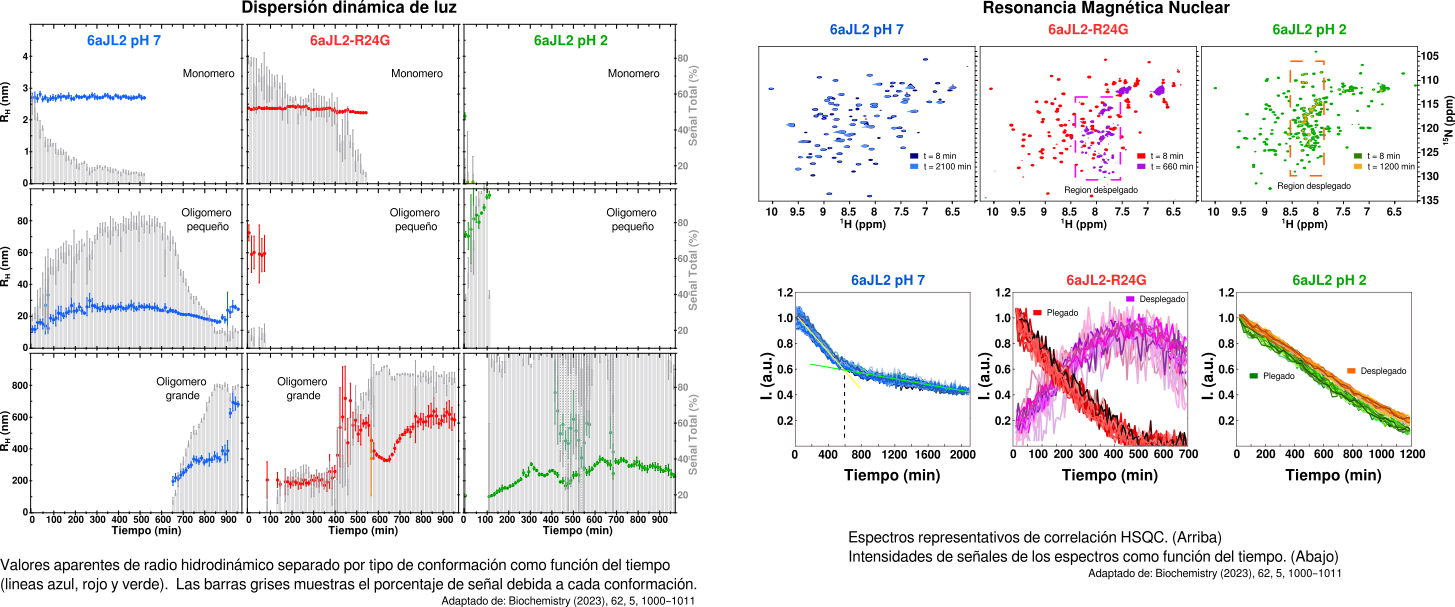
Los experimentos de DLS mostraron que al incubar las proteínas 6aJL2 pH7, 6aJL2-R24G y a 6aJL2 pH 2 a 37 °C, podemos obtener proteína monomerica, un oligomero pequeño y grandes oligomeros (agregados). Para la 6aJL2 pH7 observamos como el monomero (linea azul) predomina al principio y que, con el paso del tiempo, hay una disminución en su población (barras grises disminuyendo) (Panel A). Esta disminución, promueve que la población del oligomeros pequeños vaya aumentando, para alrededor de los 400 min, ser la especia mayoritaria. Estos oligomeros dan lugar a la formacion de grandes agregados que empezamos a detectar cerca de los 600 min En la 6aJL2-R24G detectamos una especie pequeña, que parece dar lugar directamente a la formación de los grandes oligomeros, sin necesidad de un paso intermedio. Mientras que para 6aJL2 pH2, casi lo único que logramos detectar es la formación de los grandes agregados. Los datos de RMN en tiempo real muestran una disminución de intensidad sutil y global de las señales de la proteína plegada a lo largo del tiempo, consistente con la lenta formación de oligómeros más grandes detectados en DLS, la mayoría de los cuales se vuelven silenciosos ante la RMN. Los espectros de 6aJL2 no presentan ninguna señal que pueda representar una conformación diferente, por lo que, solo pudimos detectar la transición de monómero a oligómero. Para 6aJL2-R24G observamos como la señal nativa decay en el tiempo y la aparición de nuevas señales de una segunda conformación. Estas conformación transitoria se encuentran en la región desplegada. Para 6aJL2 pH 2 desde el inicio ya observamos señales para un segunda conformación. Con el tiempo, detectamos la caída de intensidad de las señales para las dos conformaciones, sin ninguna acumulación. Esto indica la interconversión del monómero nativo al estado desplegado y luego a los agregados. Además, los estudios computacionales mostraron similitudes con sutiles diferencias en el desplegamiento de las tres proteínas. Bajo las mismas condiciones y temperatura, las proteínas pueden acceder y poblar estados semejantes. Con la información proporcionada por cada una de las técnicas utilizadas, podemos concluir que la proteína 6aJL2 a 37 °C forma oligómeros con el tiempo, pero no parece transitar por un estado desplegado. Por el contrario, para el mutante 6aJL2-R24G, pudimos detectar una transición para una conformación desplegada, que implica cambios en el entorno Trp y luego la formación de oligómeros. Finalmente, cuando la proteína 6aJL2 se incuba a pH 2 y 37 °C, sufre un desplegamiento de su estructura donde los residuos cercanos a Trp no están involucrados sino que se forman parches hidrofóbicos. La especie plegada se está interconvirtiendo a la conformación desplegada y, esta al simultanametne sufre una interconversión con los grandes oligómeros.